Молекулярные «ножницы» CRISPR-Cas9 продолжают примерять к разным мишеням. Пока одни ученые тестируют генную терапию на взрослых людях, а другие спорят о том, приемлемо ли применять ее к одноклеточным эмбрионам, третьи выбрали промежуточную цель. Они попробовали отредактировать гены «взрослых» зародышей мыши в утробе матери и избавить их от смертельной болезни легких. Несмотря на то что им удалось починить лишь 20% клеток и спасти всего 6% мышей, едва ли стоит судить строго первый в своем роде эксперимент, разметивший дорогу для следующих попыток.
Визуализация системы CRISPR-CAS9
© Ibreakstock / Фотодом / Shutterstock
Научное сообщество только начинает исследовать границы возможностей системы CRISPR-Cas9 для «починки» людей. Пока что ближе всего мы подошли к коррекции моногенетических заболеваний — наследственных патологий, вызванных мутацией одного-единственного гена. Если у эмбриона из двух копий гена мутантная лишь одна, то можно ее вырезать, оставив вторую нетронутой. По такому принципу ученые недавно избавили мышей от преждевременного старения и мышечной дистрофии.
В предыдущих экспериментах исследователи работали либо со взрослыми животными, либо с одноклеточными зародышами. Первый путь неудобен тем, что доставить молекулярные «ножницы» во все ткани тела одновременно невозможно, поэтому нервная ткань практически не «чинится». Кроме того, многие органы взрослых мышей (и людей тоже) защищены от вторжения извне, как, например, кожа или легкие, и эффективность их редактирования оказывается невелика. Что же касается одноклеточных зародышей, мы до сих пор не знаем, разрешат ли в ближайшее время подобные эксперименты на людях. К тому же на стадии одной клетки невозможно определить, действительно ли эмбрион унаследовал мутантный ген от родителей и требуется ли ему редактирование.
Поэтому американские исследователи пошли третьим путем. Они экспериментировали со «взрослыми», 16-дневными зародышами мышей (сама беременность у этих животных длится около 20 дней). Мишенью для них стало врожденное заболевание легких, вызванное мутацией в гене Sftpc. Он отвечает за выделение сурфактанта — слизи, выстилающей легкие изнутри. Мутация в Sftpc приводит к тому, что вещества — предшественники сурфактанта — не выходят из клеток легких, а копятся внутри. В результате клетки отмирают, легкие теряют эластичность, эффективность газообмена падает и носитель мутации умирает вскоре после рождения. Помочь ему может только пересадка легкого.
Исследователи работали с гетерозиготными мышами, несущими лишь одну из мутантных копий гена. «Обезвреженные» вирусы, несущие на себе гены CRISPR-Cas9, вводили инъекцией прямо в околоплодные воды беременной матери-мыши. Дальше эмбрионы «вдыхали» вирусы вместе с жидкостью, а чтобы стимулировать этот процесс, мать ненадолго помещали в камеру с повышенным содержанием углекислого газа. Эмбрионам переставало хватать кислорода, и они рефлекторно «вдыхали» глубже. Затем эффективность редактирования оценивали на разных стадиях развития: через несколько дней после инъекции, в первые дни после родов и дальше, вплоть до шести месяцев самостоятельной жизни.
Оказалось, что методика позволяет отредактировать около 20% клеток легких — они перестают накапливать лишние продукты и выделяют сурфактант на поверхность. Эта цифра остается стабильной в течение как минимум шести месяцев после появления на свет. При этом редактированию поддаются все типы эпителиальных клеток легких, а лежащие под ними клетки сосудов и соединительной ткани остаются нетронутыми. Другие органы мышей тоже не изменились на генетическом уровне, за исключением некоторых клеток пищеварительной системы, куда попала часть проглоченных околоплодных вод. Это означает, что новая технология не только действует на те клетки, которые во взрослом состоянии оказываются неприступны, но и обходит стороной другие системы органов и поэтому не вызывает побочных эффектов.
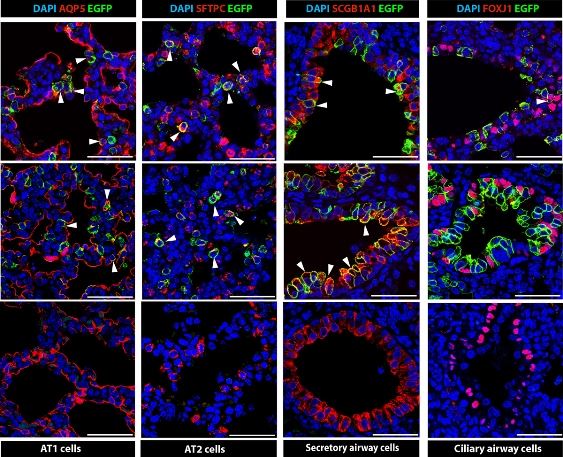
Неотредактированные эпителиальные клетки легких на изображениях отмечены синим,
а те, которые ученые смогли успешно отредактировать, — зеленым
© D. Alapati et al. / Science Translational Medicine
Правда, выживаемость мышей пока оставляет желать лучшего. Сама методика редактирования приводит к высокой смертности — в живых остались лишь 25% контрольных (здоровых) мышей, которым инъецировали вирусы с CRISPR-Cas9. Среди больных и отредактированных мышей порог в шесть месяцев преодолели лишь 5,7%. Цифра кажется маленькой, однако стоит вспомнить о том, что больные мыши без лечения умирают в первые часы после рождения.
Таким образом, первая попытка применить новую технологию принесла определенные плоды, и исследователи надеются сделать ее эффективнее и расширить поле для ее применения. Они добавляют, что избирательное редактирование отдельных систем органов избавляет нас от риска генетически модифицировать половые клетки зародыша, таким образом снимая одну из самых острых этических проблем современной науки.
Статья опубликована в журнале Science Translational Medicine
Источник: chrdk.ru